
Новые, потенциально угрожающие вирусы орхидей и их возможные пути заражения
Вирусы в общем считаются серьезной проблемой у орхидей. Инфицированные растения менее стойкие, чем их здоровые соплеменники и цветут они менее обильно. Хотя орхидные вирусы редко приводят к смерти, он них нет лечения и значит, инфицированные растения будут источником заразы бесконечно. Всего насчитывается порядка 28 вирусов орхидей, из которых только два, цимбидиумная мозаика (CyMV) и вирус пятнистости одонтоглоссумов (ORSV), были более-менее подробно изучены. (Inouye, in press; Lawson and Brannigan, 1986; Lesemann and Vetten, 1985; Wisler, Zettler, and Mu, 1987; Zettler et al., 1984).

Зеленая персиковая тля (Myzus percicae), снабженная заостренным ядовитым жалом, чтобы прокусывать ткани десмодиумов, при увеличении в 150 раз под электронным микроскопом, выглядит устрашающе. Тля является переносчиком многих вирусов растений.
ТАКСОНОМИЯ ВИРУСОВ
В 1961г. был учрежден Международный Комитет по Таксономии Вирусов. Согласно правилам Комитета, вирусы скорее определяются скорее как «группы», а не как часть номенклатурной системы Линнея, использующейся для остальных живых организмов. К тому же, вирусы чаще называются их местными названиями, а не двойными латинскими. Очевидно, что между вирусами одной группы и способами их передачи существует тесная связь. Члены некоторых групп, например, у вируса картофельной клетчатки и вируса табачной мозаики нет естественных путей распространения, а вот члены другой группы, вирусы огуречной мозаики и потивирусы, у каждого из которых есть близкие штаммы, поражающие орхидеи, обычно передаются определенными путями, например, тлёй. (Zettler et al., 1984).
Двадцать из 23 орхидных вирусов, перечисленных у Лоусона и Браннигана (1986г.), как и вирус пожелтения прожилок клевера (Inouye, in press), турнепсовая мозаика (Lesemann and Vetten, 1985), и недавно описанный вирус ванили из Французской Полинезии (Wisler, Zettler, and Mu, 1987) можно с той или иной степенью вероятности причислить к группам (Таблица 1) (Zettler et al., 1984). Из этих 23 вирусов 18 входят в группы, типично переносимые определенными членистоногими, а два водят в группы, переносимые нематодами. Оставшиеся три орхидных вируса (CyMV, ORSV, и цимбидиумая пятнистость) принадлежат группам, для которых источник передачи пока точно не установлен. Хотя научные работы по изучению передачи орхидных вирусов как таковых немногочисленны, по меньшей мере 6 из них доказывают, что к этому причастна тля: желтая мозаика бобовых, вирус пожелтения прожилок клевера, огурцовая мозаика, мозаика дендробиумов, турнепсовая мозаика, и потивирус ванили (Inouye, 1971; Inouye, in press; Lawson and Brannigan, 1986; Lesemann and Vetten, 1985; Wisler, Zettler, and Mu. 1987).

Вирусы цимбидиумной мозаики и пятнистости одонтогроссумов — Вирус цимбидиумной мозаики (CyMV), потексвирус и вирус пятнистости одонтоглоссумов (ORSV), тобамовирус, были описаны более 30 лет назад и встречаются повсеместно, где орхидеи выращиваются, как комнатные цветы (Lawson and Brannigan, 1986; Wisler, Zettler, and Sheehan, 1986; Zettler et al., 1984). И наоборот, наблюдения показали, что эти оба вируса практически не встречаются на ванильных плантациях во Французской Полинезии (Wisler, Zettler, and Mu, 1987; Wisler, Zettler and Sheehan, 1979). Аналогично, поскольку вирусы не передаются при семенном размножении, сеянцы орхидей, которые еще не успели поделить, инфицированными не будут (Wisler, Zettler, and Sheehan, 1979; Zettler et al., 1984). Как и другие члены этих вирусных групп, ни CyMV (группа потексвирусов), ни ORSV (группа тобамовирусов) не могут передаваться членистоногими или нематодами. Эти вирусы передаются через зараженные режущие инструменты. А значит, этот путь передачи можно пресечь, дезинфицируя инструменты в противовирусном растворе, например, в бытовой хлорке (Clorox) (Lawson and Brannigan, 1986; Wisler, Zettler, and Sheehan, 1986). Этот же способ эффективен и против остальных вирусов орхидей, у большинства которых значительно более низкая сопротивляемость инактивации, чем у CyMV и ORSV. И хотя у орхидей, пораженных CyMV и/или ORSV редко проявляются явные симптомы, их можно наверняка определить другими методами, например, биотест, серологический тест, под обычным или электронным микроскопом (Christie, Ko, and Zettler, 1986; Ko, Zettler, and Wisler, 1985; Ko et al., 1985; Lawson and Brannigan, 1986; Wisler, Zettler and Sheehan 1983).

Сепалии и петалии этого и ниже Dendrobium bigibbum говорят о поражении венозным некрозом, выражающимся в появлении пятен, характерных для вируса венозного некроза дендробиумов.
 Другие вирусы — В отличие от хорошо изученных CyMV и ORSV, о большинстве других вирусов, поражающих орхидеи, известно мало. И хотя известно, что некоторые из них, как к примеру вирус венозного некроза дендробиумов (Lesemann, 1977), усугубляют состояние растения, о их распространении, способах передачи или растениях-хозяевах в семействе орхидных известно крайне мало. Не хватает и надежной диагностики, прежде всего из-за особенностей этих вирусов, сильно усложняющих их изучение в сравнении с CyMV и ORSV. И хотя применение современных микроскопов (Christie, Ko, and Zettler, 1986: Ko et al., 1985) упростило задачу изучения этих малоизученных вирусов, вряд ли в ближайшие годы в этом вопросе наметится какой-либо существенный сдвиг. К несчастью, сложившаяся ситуация сильно беспокоит орхидеистов, стремящихся уберечь здоровье своих растений. Для орхидеистов особенно важно знать о путях передачи вирусов, чтобы избежать заражения здоровых растений в коллекциях.
Другие вирусы — В отличие от хорошо изученных CyMV и ORSV, о большинстве других вирусов, поражающих орхидеи, известно мало. И хотя известно, что некоторые из них, как к примеру вирус венозного некроза дендробиумов (Lesemann, 1977), усугубляют состояние растения, о их распространении, способах передачи или растениях-хозяевах в семействе орхидных известно крайне мало. Не хватает и надежной диагностики, прежде всего из-за особенностей этих вирусов, сильно усложняющих их изучение в сравнении с CyMV и ORSV. И хотя применение современных микроскопов (Christie, Ko, and Zettler, 1986: Ko et al., 1985) упростило задачу изучения этих малоизученных вирусов, вряд ли в ближайшие годы в этом вопросе наметится какой-либо существенный сдвиг. К несчастью, сложившаяся ситуация сильно беспокоит орхидеистов, стремящихся уберечь здоровье своих растений. Для орхидеистов особенно важно знать о путях передачи вирусов, чтобы избежать заражения здоровых растений в коллекциях.
Насекомые как потенциальные разносчики вирусов
Многоножки, клещи, нематоды, слизни, улитки и 8 видов насекомых являются самыми распространенными паразитами орхидей (Hamon, 1986). Насекомые-паразиты – это тля (Homoptera: Aphididae), короед (Coleoptera), гусеницы (Lepidoptera), перепончатокрылые (Hymenoptera), тараканы (Orthoptera), мошкара (Diptera), мучнистый червец (Homoptera: Coccidae), щитовки (Homoptera: Coccidae), ногохвостки (Collembola), и трипсы (Thysanoptera). Исходя из природы орхидных вирусов, очень мало шансов, что гусеницы, тараканы, многоножки, слизни и ногохвостки могут их переносить, в том числе и вирусы CyMV и ORSV.
Более 380 видов животных способны переносить хотя бы один вирус растений, причем 93% от общего числа приходится на насекомых, 6% на нематод и 1% на клещей (Harris. 1981). Из насекомых определенный гнус, короеды, тля и трипсы могут переносить хотя бы один вирус растений (Harris, 1981). Из них самым вероятным переносчиком вирусов орхидей является Homoptera – тля. Согласно Харрису (1981г.), 76% всех известных насекомых-переносчиков вирусов растений входят в этот род.
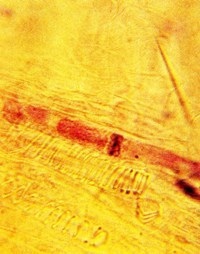 Под микроскопом сосудистая ткань Dendrobium bigibbum, называющаяся флоэма, прокрашенная красящим веществом, показывает красно-фиолетовые включения, характерные для вируса венозного некроза дендробиумов.
Под микроскопом сосудистая ткань Dendrobium bigibbum, называющаяся флоэма, прокрашенная красящим веществом, показывает красно-фиолетовые включения, характерные для вируса венозного некроза дендробиумов.
Мошкара, жуки и трипсы — было экспериментально доказано, что только два вида листоссосущих летающих насекомых способны переносить вирусы растений, и оба принадлежат к роду Liriomyza (Diptera). Поэтому очень маловероятно, что грибковые комарики (Bradysia spp.), встречающиеся в коллекциях орхидей, могут быть источником заражения. Хотя жуки (Coleoptera) и трипсы (Thysanoptera) могут переносить ряд серьезных вирусов растений, например bromoviruses, comoviruses, sobemoviruses. Tymoviruses и вирус пятнистого увядания томатов, ни один из них не поражает орхидеи (Harris, 1981; Zettler et al., 1984).
Клещи— Клещи тоже не похожи на переносчиков вирусов. Три вируса растений, поражающих травы, могут переноситься с отдельными видами клещей семейства Eriophyidae (Harris, 1981г.). Но клещи – паразиты орхидей (Brevipalpus, Tenuipalpus и Tetranychus spp.) принадлежат к семействам, не переносящим эти вирусы (Hamon, 1986г.).
Нематоды — Табачная погремковость и вирус табачной пятнистости передаются оба нематодами рода Dorylaimida (Harris, 1981г.), и оба способны поражать орхидеи (Lawson and Brannigan, 1986г.). Однако же, в большинстве коллекций орхидей популяция нематод немногочисленна (Hamon, 1986г.), потому что большинство эпифитных и большинство наземных орхидей выращивают в безземельных субстратах, препятствующих росту популяции нематод.
Вирус цимбидиумной пятнистости — Вирус цимбидиумной пятнистости, томбусвирус, был уничтожен в орхидеях в Европе (Lawson and Brannigan, 1986г.). Есть сведения, что вирус способен передаваться через почву. Другие томбусвирусы были найдены в озерах и ручьях Европы, но об эпидемиологической значимости этих данных еще предстоит сделать выводы (Koenig and Lesemann, 1985г.).
Homoptera (тля, щитовки, мучнистый червец) — Большинство вирусов растений переносится тлей, чем другими насекомыми. Именно тля, судя по всему, переносит большинство вирусов орхидей. На долю этих насекомых приходится 71% всех переносчиков рода Homoptera, и они переносят порядка 55% всех переносимых членистоногими вирусов растений (Harris, 1981г.). Хотя щитовки и мучнистый червец встречаются в коллекциях орхидей гораздо чаще тли (Hamon, 1986г.), установлено, что они переносят всего лишь пять вирусов растений. Четыре из них поражают какаовые деревья (Harris, 1981г.), и ни один их них не поражает орхидеи.
 Этот вид тли, Aphis gossypii обосновался на цветоносе орцидиума. Обратите внимание на крылатого представителя на втором сверху бутоне
Этот вид тли, Aphis gossypii обосновался на цветоносе орцидиума. Обратите внимание на крылатого представителя на втором сверху бутоне
Тля часто встречается в коллекциях орхидей, особенно на бутонах и цветоносах, но редко бросается в глаза, так как не часто образует большие колонии (Hamon, 1986г.). Довольно много видов тли паразитирует на орхидеях, в том числе Aphis gossypii, Cerataphis orchidearum, Macrasiphum (Silobion) luteum, Myzus persicae и Neomyzus circumflexus (= Aulacorthum circumflexus) (Eastop, 1966г.; Hamon, 1986г.; Smith, Martorell, and Perez, 1963г.). Aphis gossypii и Myzus persicae - самые опасные переносчики вирусов. Первая способна переносить порядка 81 вируса растений, а вторая - 182 (Kennedy, Day, and Eastop, 1962г.).
Все шесть вирусов орхидей, передаваемых посредством членистоногих (желтая мозаика бобовых, вирус венозного пожелтения клевера, огурцовая мозаика, мозаика дендробиумов, турнепсовая мозаика и потивирус ванили из Французской Полинезии) передаются тлёй (Lawson and Brannigan, 1986г.; Matthews, 1982г.; Wisler, Zettler, and Mu, 1987г.).
 Эта брасия из США явно поражена безымянным рабдовирусом.
Эта брасия из США явно поражена безымянным рабдовирусом.
Высокая степень вероятности распространения вирусов орхидей через укусы тли выводится из сравнения путей инфицирования вирусами этих растений и остальных растений. Основываясь на этом, 18 вирусов орхидей, принадлежащих к групам клостеро-, кукумо-, поти- и рабдовирусов скорее всего передаются тлёй (таблица1). Большинство всех известных клостеро-, кукумо- и потивирусов в природе передаются исключительно тлёй (Matthews, 1982г.). Рабдовирусы могут распространяться через тлю, саранчу (Homoptera: Cicadellidae), и жесткокрылых – фонарниц (Homoptera: Fulgoridae). И всё же, в горшечной культуре орхидей находят преимущественно именно тлю (Hamon, 1986г.).
Тля, с ее кусающе-сосущим ротовым аппаратом, может распространять вирусы тремя способами: не оставаясь носителем, становясь носителем на некоторое время, без носительства (Harris, 1981г.). Кукумо- и потивирусы передаются без инфицирования самого насекомого, клостеровирусам нужно инфицировать насекомое на некоторое время, а рабдовирусы живут в самом насекомом.
Вирусы без носительства передаются от больных растений к здоровым в течение секунд или минут. В этом случае вирусы прикрепляются к кусательному аппарату (жалу), в момент прокуса поверхности листа. Вирус переносится на острие жала и отрывается т него, как только насекомое перелетает на здоровое растение, чтобы подкрепиться.
Вирусы, которые передаются насекомым-носителем, передаются самыми различными способами. В этом случае насекомое фактически поглощает вирус, попадающий в его пищеварительный аппарат (желудок). Затем вирус может проникать в стенки желудка, попадать в кровеносную систему, и уже оттуда - в слюнные железы, откуда вирус уже проникает в новое растение, когда тля питается здоровым растением. Этот непростой процесс предполагает, что тля должна в течение нескольких дней поглощать вирус, чтобы его концентрация была достаточной для проникновения в слюнные железы и через них инфицирования нового растения. Однако же, в отличие от передачи вируса без носительства, в этом случае тля может оставаться вирусоносителем всю жизнь.
Как следует из самого термина, полуносительство – это нечто среднее между простой передачей вируса и его носительством. В отличие от вирусов, предполагающих носительство, при полуносительстве вирус не циркулирует по пищеварительному тракту тли. Наоборот. Вирус просто накапливается в желудке тли и выводится, когда тля питается на здоровом растении.
ЗАКЛЮЧЕНИЕ
 Цветонос фаленопсиса из Тайваня поражен вирусом огуречной мозаики, вирусом, передаваемым тлёй.
Цветонос фаленопсиса из Тайваня поражен вирусом огуречной мозаики, вирусом, передаваемым тлёй.
Тля - или доказанный, или же самый вероятный путь передачи большинства вирусов орхидей, а значит, являются угрозой, даже если сами по себе они и не наносят видимого вреда растению. Возможно, на полное изучение путей передачи всех вирусов орхидей понадобятся годы, а пока остается тщательно контролировать появление тли в коллекциях. Обработки от тли и стерилизация режущего инструмента при делении растений и срезке цветов – основные средства уменьшения риска распространения вирусов в орхидных теплицах.
Благодарности
Выражаем благодарность Американскому Орхидному Обществу и Национальному Научному Совету Китайской Народной Республики за поддержку этого проекта.
Использованная литература
1) Christie, R. G.. N.-J. Ko. and F. W. Zettler. 1986. Light microscopic techniques for detection and diagnosis of orchid virus diseases. Amer. Orchid Soc. Bull. 5.5: 996-1007.
2) Eastop, V. F. 1966. A taxonomic study of Australian Aphidoidea (Homoptera). Austral. Zool. 14: 399-592.
3) Hamon, A. B. 1986. Orchid pests. Pages 50-63 in Handbook on Orchid Pests and Diseases. American Orchid Society, West Palm Beach, Florida.
4) Harris, K. F. 1981. Arthropod and nematode vectors of plant viruses. Annual Rev. Phytopathol. 19: 391-426.
5) Inouye, N. 1971. Virus diseases of orchids. (V) Symptoms and properties of viruses in Dendrobium. Jap. Orchid Soc. Bull. 17: 3-7.
6) --------- . In press. Viruses found in orchids in Japan. Proc. 12th World Orchid Conf., Tokyo, Japan.
7) Kennedy, J. S. M. F. Day, and V. F. Eastop. 1962. A conspectus of aphids as vectors of plant viruses. Commonwealth Agricultural Bureau. Farnham Royal, Bucks. England.
8) Ko, N.-J., F. W. Zettler. and G. C. Wisler. 1985. A simplified bioassay technique for cymbidium mosaic and odontoglossum Ringspot viruses. Amer. Orchid Soc. Bull. 54: 1080-1082.
J. R. Edwardson, and R. G. Christie. 1985. Light microscopic techniques for detecting orchid viruses. Ada Hurl. 16-1: 211-253. Koenig, R.. and D. E. Lesemann. 1985. Plant viruses in German rivers and lakes. (I.) Tombusviruses, a potexvirus and carnation motile virus. Phytopathol. Z. 112: 105-116.
9) Lawson, R. H., and M. Brannigan. 1981). Virus diseases of orchids. Pages 2-49 in Handbook on Orchid Pests and Diseases. American Orchid Society. West Palm Beach. Florida.
10) Lesemann. D. E. 1977. Long, filamentous virus-like particles associated with vein necrosis of Dendrobium phalaenopsis. Phytopathol. Z. 89: 330-339.
- and J. f. Vet ten. 1985. 'File occurrence of tobacco rat tie and turnip mosaic viruses in On his spp., and an unidentified potyvirus of Cypripedium calceolus. Ada Hurl. 164: 45-54.
11) Matthews. R. E. F. 1982. Classification and nomenclature of viruses. S. Karger. New York.
12) Smith. C. F.. L. F. Martorell. and M. E. Perez. 1963. Aphididae of Puerto Rico. Univ.. Puerto Rico Tech. Paper No. 37.
13) Wisler, G. C., F. W. Zettler. and L. Mu. 1987. Viruses infecting Vanilla in French Polynesia. Amer. Orchid Soc. Bull. 56: 381-387.
- and 'F. J. Sheehan. 1979. Relative incidence of cymbidium mosaic and odontoglossum ringspot viruses in several genera of wild and cultivated orchids. Proc. Fla. State Hort. Soc. 92: 339-340.
- 1983. A diagnostic technique developed for orchid growers to detect cymbidium mosaic and odontoglossum ringspot viruses. Amer. Orchid Soc. Bull. 52:255-261.
_____________ , and______ . 1986. Common questions and misconceptions concerning orchid viruses. Amer. Orchid Soc. Bull. 55: 472-479.
14) Zettler, F. W., G. C. Wisler, T. J. Sheehan, N.-J. Ko. and A. E. Logan. 1984. Viruses — some basics and a perspective for orchid growers. Amer. Orchid Soc. Bull. 53: 505-511.
